Struktur Pelarut Organik
Sebelum loe mengerti sifat sifat pelarut organik, loe juga perlu mengetahui rumus strukturnya.
Berikut ini adalah rumus struktur dari pelarut-pelarut tersebut :
Benzena Sikloheksana
Kloroform Etanol

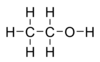
Metanol
n-heksana
Dilihat dari struktur-struktur pelarut di atas, maka dapat diketahui pelarut yang bersifat polar dan bersifat nonpolar. Kepolaran suatu senyawa dipengaruhi oleh simetris tidaknya bentuk molekul dan titik lebur.Pelarut-pelarut di atas yang termasuk
senyawa polar adalah :
etanol
methanol
air
sedangkan untuk senyawa nonpolar adalah:
benzena
sikloheksana
n-heksana
kloroform.
Kelarutan Suatu Zat Dalam Pelarut Organik
Percobaan ini menggunakan 4 sampel yang wujudnya padat yaitu sukrosa, naftalena, vaselin dan gula putih. 4 sampel yang berbeda ini kemudian direaksikan dengan pelarut-pelarut yang telah ditentukan.
Sampel A (sukrosa)
rumus molekul : C12H22O11
sifat : -membentuk ikatan hidrogen.
-senyawa yang bersifat polar.
-larut dalam pelarut polar
-tidak larut dalam pelarut nonpolar .
Dalam percobaan untuk kelarutan suatu zat dalam pelarut organik ini, sukrosa dicampurkan dengan berbagai pelarut, yaitu:
1. Pelarut benzena
Berdasarkan hasil pengamatan dari percobaan yang sudah dilakukan, ketika sukrosa dicampur dengan pelarut benzena, pada mulanya tidak larut. Dan pada saat campuran tersebut dipanaskan, sukrosa menjadi larut dalam benzena. Padahal seharusnya senyawa yang bersifat polar tidak larut pada senyawa yang besifat nonpolar.
2. Pelarut etanol
Sukrosa yang dicampur dengan etanol tidak larut meskipun dipanaskan. Padahal etanol dan sukrosa sama-sama bersifat polar. Hal ini mungkin dikarenakan sukrosa yang diambil telah terkontaminasi oleh zat lain yang akibatnya menyebabkan tidak larutnya sukrosa dalam etanol.
3. Pelarut sikloheksana
Sikloheksana merupakan alkana yang berbentuk siklik yang jika dilihat dari strukturnya bersifat nonpolar karena strukturnya simetri dan tidak dapat membentuk ikatan hidrogen. Pada percobaan, sukrosa dicampur dengan sikloheksana mulanya tidak melarut, tetapi larut setelah dipanaskan. Seharusnya, senyawa polar tidak larut pada senyawa nonpolar. Ini mungkin karena adanya kesalahan-kesalahan dalam percobaan.
4. Pelarut air
Pada saat pencampuran sukrosa dan aquadest, yang terjadi adalah keduanya saling melarut meskipun tanpa pemanasan. Hal ini dikarenakan, kedua senyawa tersebut bersifat polar sehingga lebih mudah untuk melarut.
5. Pelarut kloroform, n-heksana, dan metanol
Sukrosa yang dicampurkan dengan pelarut-pelarut ini tidak melarut meskipun dipanaskan. Padahal seharusnya sampel sukrosa larut saat dicampurkan dengan pelarut metanol karena sama-sama bersifat polar. Metanol mempunyai gugus -OH sehingga mampu membentuk ikatan hidrogen antar molekul dan bobot molekulnya rendah. Satu atomnya mempunyai keelektronegatifan yang substansial lebih besar dari yang lain. Semakin elektronegatif satu atom makin besar tarikannya terhadap elektron ikatan. Tarikannya tdak cukup untuk memecahkan atmnya menjadi ion. Tetapi mempunyai bagian rapat elektron yang lebih besar sehingga metanol merupakan senyawa polar.
Seharusnya sukrosa juga melarut ketika ditambahkan ke dalam metanol tetapi hasil percobaan menunjukkan sukrosa tidak melarut dalam methanol. Hal ini terjadi mungkin disebabkan oleh perbedaan dielektrik sebesar 7,85, metanol sebesar 32,6, dan etanol sebesar 24,5. Semakin tinggi tetapan dielektriknya maka semakin polar larutan tersebut dan kemampuan untuk melarutkan semakin tinggi sehingga sukrosa lebih mudah larut dalam air dibandingkan di dalam methanol maupun etanol. Alasan lain adalah kemungkinan terjadi kesalahan yang dilakukan oleh praktikan dalam praktikum. Mungkin praktikan tidak melakukan pengadukan dan pemanasan secara maksimal sehingga dalam pengamatan praktikan belum sempat melihat secara langsung sukrosa dapat melarut dalam methanol.
b. Sampel B (naftalena)
 Rumus molekul :gabungan struktur resonansi dan benzena
Rumus molekul :gabungan struktur resonansi dan benzena sifat : -non-polar
-larut dengan zat pelarut non-polar.
2. Pelarut polar (etanol, air, dan metanol)
Saat naftalena dicampurkan dengan etanol, sampel melarut sebagian dan larut setelah dipanaskan. Kemudian pencampuran naftalena dengan air, sampel tetap tidak larut meskipun dipanaskan. Sedangkan ketika dicampur deengan metanol, naftalena larut tanpa dipanaskan. Padahal secara teori seharusnya senyawa yang bersifat non-polar (naftalena) tidak larut pada senyawa yang bersifat polar. Hal ini bisa terjadi karena methanol maupun etanol memiliki tingkat kepolaran yang lebih rendah jika dibandingkan dengan air. Alasan lain adalah karena etanol maupun methanol memilikimdua gugus yang bersifat polar dan nonpolar, gugus polarnya adalah OH dan gugus polarnya adalah CH3 sehingga etanol maupun methanol dapat larut pada zat polar dan nonpolar.
c. Sampel C (Vaselin)
sifat : nonpolar tidak bisa membentuk ikatan hidrogen.
Berdasarkan hasil pengamatan,vaselin dapat larut dalam pelarut benzena, sikloheksana,dan n-heksana. Seharusnya dalam pelarut kloroform, vaselin dapat melarut tetapi berdasarkan hasil percobaan vaselin tidak larut dalam kloroform.Dilihat dari nilai tetapan dielektriknya, kloroform memiliki nilai yang paling tinggi di antara yang lainnya yaitu benzena, sikloheksana, dan n-heksana. Benzena memiliki tetapan dielektrik sebesar 2,284, sikloheksana 1,924, n-heksana 1,890, dan kloroform 4,806. Ini menunjukkan sifat nonpolar kloroform paling rendah dibandingkan tiga pelarut nonpolar lainnya. Hal ini mungkinmenyebabkan vaselin tidak larut dalam kloroform.
Untuk pelarut yang polar yaitu metanol, etanol, dan air hasil percobaan menunjukkan bahwa vaselin memang tidak larut dalam ketiga pelarut tersebut. Hal ini terjadi karena perbedaan sifat kepolaran antara vaselin dengan metanol, etanol dan air.
d. Gula putih ( Glukosa )
Sifat : -polar
-dapat membentuk ikatan hidrogen
Berdasarkan hasil percobaan untuk pelarut polar, gula putih dapat larut dalam pelarut air, metanol dan etanol. Meskipun untuk pelarut metanol dan etanol harus dilakukan pemanasan terlebih dahulu agar glukosa dapat melarut. Permasalahan di atas kemungkinan disebabkan oleh besar kecilnya nilai tetapan dielektriknya yang mempengaruhi tingkat kepolaran untuk masing-masing pelarut polar. Air dengan tetapan dielektrik 78,5 memiliki sifat yang paling polar, metanol 32,6 memiliki sifat polar lebih rendah daripada air, dan etanol 24,3 memiliki sifat polar paling rendah daripada air dan metanol, sehingga gula putih lebih mudah larut dalam air di bandingkan pada metanol dan etanol.
Untuk pelarut nonpolar ,gula putih tidak dapat larut pada pelarut benzena, sikloheksana, dan n-heksana.seharusnya untuk pelarut kloroform gula putih tidak dapat larut tetapi hasil percobaan menunjukkan gula putih dapat larut dalam kloroform. Hal ini bisa terjadi mungkin karena perbedaan tingkat nonpolar diantara pelarut-pelarut tersebut.dengan tetapan dielektrik benzena 2,284, sikloheksana 1,924, n-heksana 1,890 dan kloroform 4,806 menunjukkan bahwa pelarut nonpolar untuk kloroform paling rendah dibanding tiga pelarut lainnya.ini yang menyebabkan gula putih dapat larut dalam kloroform meskipun harus dilakukan pemanasan.Alasan lain adalah kemungkinan terjadinya ikatan hidrogen antara gula putih dengan kloroform sehingga meningkatkan kelarutan campuran gula putih dan kloroform.
Pencampuran Antar Pelarut Organik
Pada percobaan kedua ini, sampel yang digunakan adalah berwujud cair.
a. Sampel D (Air)
 sifat : -memiliki ikatan hidrogen intermolekul
sifat : -memiliki ikatan hidrogen intermolekul-mempunyai momen dipol tinggi sebesar 1,850D
-tetapan dielektriknya 78,5
-mempunyai kemampuan untuk mensolvasi
-ionnya besar
-senyawa polar.
Pada pencampuran antar pelarut organik ini, air ditambahkan dengan pelarut-pelarut yang telah ditentukan:
1. Pelarut polar (air, metanol, dan etanol)
Air yang dicampurkan dengan pelarut-pelarut tersebut dapat larut dengan mudah karena memiliki kesamaan sifat, yaitu sama-sama bersifat polar.
2. Pelarut non-polar (benzena, sikloheksana, kloroform, dan n-heksana)
Dalam pencampuran air dengan pelarut-pelarut tersebut terlihat adanya dua lapisan yang menunjukkan bahwa sampel tidak larut, dimana air selalu berada pada lapisan bawah karena air memiliki massa jenis yang lebih berat di bandingkan benzena, sikloheksana, n-heksana dan kloroform. Massa jenis air sebesar 1.000 g/ mL sedangkan massa jenis benzena 0,879 g/mL, n-heksana 0,655 g/mL, dan kloroform 1, 498 g/mL.
b. Sampel E (n-heksana)
sifat : -non-polar
-larut dalam pelarut organik yang bersifat non-polar
Pada percobaan, heksana dicampurkan dengan pelarut berikut, yaitu:
1. Pelarut polar (air,metanol, dan etanol)
Pencampuran dengan pelarut polar ini menyebabkan sampel n-heksana tidak larut karena sifat sampel yang non-polar berbeda dengan sifat pelarutnya.
2. Pelarut non-polar (benzena, sikloheksana, klorofom, dan n-heksana)
Sampel yang dicampur dengan benzena, kloroform, dan n-heksana dapat larut karena memiliki sifat yang sama yaitu non-polar. Tetapi pada saat pencampuran sampel dengan sikloheksana, berdasarkan pengamatan sampel tidak larut, terdapat lapisan berwarna keruh pada bagian atas dan berwarna bening pada bagian bawah.
Berdasarkan hasil pengamatan, n-heksana memang larut dalam benzena, sikoheksana dan kloroform karena sama-sama bersifat nonpolar. Sedangkan ketika dicampur dengan air, etanol dan methanol, n-heksana tidak larut tetapi terbentuk 2 lapisan karena perbedaan sifat kepolarannya.
KESIMPULAN
1. Sampel yang bersifat polar : sukrosa, gula putih dan air.
Sampel yang bersifat nonpolar : naftalena, vaselin dan n-heksana.
2. Pelarut yang bersifat polar : air, etanol dan metanol.
Pelarut yang bersifat nonpolar : benzena, kloroform, sikloheksana dan n-heksana.
3. Sampel yang bersifat polar dapat larut dalam pelarut polar.
Sampel yang bersifat nonpolar dapat larut dalam pelarut nonpolar.
JAWABAN PERTANYAAN GURU LOE
Perbedaan antara senyawa polar dan senyawa non-polar adalah....jawaban :
- Senyawa polar adalah senyawa yang merupakan momen dipol lebih besar dari pada nol karena molekul yang menyusun adalah molekul yang mempunyai yang tidak sejenis dan memiliki perbedaan keelektronegatifan serta mempunyai struktur bangun asimetris.
- Senyawa non-polar adalah senyawa yang mempunyai momen dipol sama dengan nol (? = 0). Hal ini dikarenakan molekul yang mempunyai atom sejenis atau molekul tidak sejenis tetapi rumus bangunnya berbentuk asimetris, sehingga tidak ada kecenderungan titik berat elektron menuju salah satu molekul.
Pemanasan terhadap pelarut organik tidak boleh menggunakan api langsung karena?
jawaban:
- ikatan yang terjadi pada pelarut organik adalah ikatan kovalen, sehingga apabila dipanaskan secara langsung akan berakibat mudah putusnya ikatan antara karbon. Pemutusan ikatan tersebut dapat menyebabkan senyawa organik itu mudah terbakar dan mudah rusak, sehingga tidak dapat digunakan lagi karena terjadi perubahan bentuk molekul senyawa.
Berdasarkan strukturnya kepolaran pelarut dapat dikelompokkan menjadi :
Jawaban:
- Pelarut polar : air, metanol dan etanol
- Pelarut non-polar : benzena, sikloheksana, n-heksana dan kloroform.
Jawaban:
- Sampel A bersifat polar : Bersifat polar karena larut dalam air dan etanol, tidak larut dalam benzena, kloroform, sikloheksana, n-heksana.
- Sampel B bersifat non-polar : Bersifat nonpolar karena larut dalam pelarut nonpolar yaitu benzena, kloroform, sikloheksana, n-heksana
- Sampel C bersifat non-polar : Bersifat nonpolar karena larut dalam pelarut nonpolar yaitu benzena, sikloheksana, n-heksana.
- Sampel D bersifat polar : Bersifat polar karena larut dalam pelarut polar yaitu air, metanol dan etanol
- Sampel E bersifat non-polar : Bersifat nonpolar karena larut dalam pelarut nonpolar yaitu benzena, sikloheksana, n-heksana dan kloroform.
Berdasarkan struktur, kepolaran sampel yang termasuk polar dan nonpolar adalah
Jawaban:
- Senyawa polar : sukrosa, air dan gula putih
- Senyawa non-polar : naftalena, vaselin, n-heksana
- Ketetapan dielektrik, yaitu nisbah gaya yang bekerja antara dua muatan itu dalam pelarut.
- Dapat tidaknya membentuk ikatan hidrogen. Adanya ikatan hidrogen membuat kelarutan zat semakin besar.
- Panjang rantai karbonnya. Semakin panjang rantai karbonnya, akan semakin kecil kelarutannya.
- Kemiripan struktur. Zat akan mudah larut jika memiliki kemiripan struktur.
- Jenis zat terlarut. Tiap zat mempunyai kelarutan masing-masing pada suatu pelarut umumnya semua asam mudah larut dalam air kecuali beberapa asam saja yang sulit larut.
- Jenis zat pelarut. Zat terlarut dibedakan atas pelarut polar adan nonpolar.
- Suhu. Kelarutan akan semakin besar pada suhu tinggi. Oleh karena itu kelarutan diukur pada keadaan tertentu.
Jawaban:
- Air : 1,84 D
- Kloroform : 1,01 D
- Etanol : 1,69 D
- Metanol : 1,70 D
- Benzena : 0 D
- Sikloheksana : 0 D
- N-heksana : 0 D









klau sumbernya dari buku apa bro?
BalasHapusklau bisa cantumin sumbernya jga bro
Itu sumbernya dati.mana yah
BalasHapusKelarutan suatu senyawa pada umumnya akan meningkat ketika suhu dinaikkan, jadi wajar senyawa2 tersebut jadi terlarut ketika suhu meningkat,
BalasHapusDan bukannya senyawa tersebut pada suhu ruang tidak dapat larut, hanya saja kelarutan nya kecil, semoga bermanfaat
nuhun a sangad bermanfaat
BalasHapus